Seedetrakti submukosaalsed kasvajad (SMT) on kõrgenenud kahjustused, mis pärinevad lihaskesta limaskestast, submukoosist või lihaskesta propriast ning võivad olla ka ekstraluminaalsed kahjustused. Meditsiinitehnoloogia arenguga on traditsioonilised kirurgilised ravivõimalused järk-järgult jõudnud minimaalselt invasiivse ravi ajastusse, näiteks laparoskoopiline kirurgia ja robotkirurgia. Kliinilises praktikas võib aga leida, et "kirurgia" ei sobi kõigile patsientidele. Viimastel aastatel on endoskoopilise ravi väärtusele järk-järgult tähelepanu pööratud. Avaldatud on Hiina ekspertide konsensuse uusim versioon SMT endoskoopilise diagnoosimise ja ravi kohta. See artikkel annab lühidalt asjakohaseid teadmisi.
1.SMT epideemia iseloomristikud
(1) SM-i esinemissagedusT on seedetrakti erinevates osades ebaühtlane ja magu on SMT kõige levinum koht.
Erinevate esinemissagedusSeedetrakti osade jaotus on ebaühtlane, kusjuures ülemine seedetrakt on sagedasem. Neist 2/3 asuvad maos, millele järgnevad söögitoru, kaksteistsõrmiksool ja jämesool.
(2) Histopatoloogiline uuringL SMT tüübid on keerulised, kuid enamik SMT-sid on healoomulised kahjustused ja ainult mõned on pahaloomulised.
A.SMT ei sisaldan-neoplastilised kahjustused, näiteks ektoopiline pankreasekoe ja neoplastilised kahjustused.
B. Neoplastiliste kahjustuste hulgasSeedetrakti leiomüoomid, lipoomid, brutsella adenoomid, granulosarakkude kasvajad, schwannoomid ja glomuskasvajad on enamasti healoomulised ning alla 15% neist võivad ilmneda kudedena. Õpi paha.
C. Seedetrakti stroomSMT-ga seotud l-kasvajad (GIST) ja neuroendokriinsed kasvajad (NET) on teatud pahaloomulise potentsiaaliga kasvajad, kuid see sõltub nende suurusest, asukohast ja tüübist.
D. SMT asukoht on seotudpatoloogilise klassifikatsiooni järgi: a. Leiomüoomid on söögitorus levinud SMT patoloogiline tüüp, moodustades 60–80% söögitoru SMT-dest ja esinedes tõenäolisemalt söögitoru keskmises ja alumises segmendis; b. Mao SMT patoloogilised tüübid on suhteliselt keerulised, kusjuures GIST, leiomüomüoomc. Lipoomid ja tsüstid on kõige levinumad. Mao SMT korral esineb GIST kõige sagedamini mao põhjas ja kehas, leiomüoom paikneb tavaliselt kardias ja keha ülaosas ning ektoopiline pankreas ja ektoopiline pankreas on kõige levinumad. Lipoomid esinevad sagedamini mao antrumis; c. Lipoomid ja tsüstid esinevad sagedamini kaksteistsõrmiksoole laskuvas ja bulboosses osas; d. Seedetrakti alumise osa SMT korral on lipoomid valdavalt käärsooles, samas kui NET-id on valdavalt pärasooles.
(3) Kasvajate astme määramiseks, raviks ja hindamiseks kasutage kompuutertomograafiat ja magnetresonantstomograafiat. Lõualuu kasvajate puhul, mille puhul kahtlustatakse potentsiaalselt pahaloomulist kasvajat või millel on suured kasvajad (pikadläbimõõt > 2 cm), on soovitatav kompuutertomograafia ja magnetresonantstomograafia.
Teised pildistamismeetodid, sh kompuutertomograafia ja magnetresonantstomograafia, on samuti SMT diagnoosimisel väga olulised. Need suudavad otseselt kuvada kasvaja esinemise asukohta, kasvumustrit, kahjustuse suurust, kuju, lobulatsiooni olemasolu või puudumist, tihedust, homogeensust, kontrasteerumise astet ja piiride kontuuri jne ning suudavad leida, kas ja kui suur on paksus.seedetrakti seina avamine. Veelgi olulisem on see, et need pildiuuringud suudavad tuvastada, kas esineb invasioon kahjustuse külgnevatesse struktuuridesse ja kas ümbritsevas kõhukelmes, lümfisõlmedes ja teistes organites on metastaase. Need on peamine meetod kasvajate kliiniliseks hindamiseks, raviks ja prognoosimiseks.
(4) Koeproovide võtmist ei soovitata.Soovitatav healoomuliste seljaaju kasvajate korral, mida saab diagnoosida tavapärase endoskoopia ja EUS-i kombinatsiooni abil, näiteks lipoomid, tsüstid ja ektoopiline pankreas.
Pahaloomuliste kahtlustatavate kahjustuste korral või kui tavapärase endoskoopia ja EUS-i kombinatsioon ei võimalda healoomulisi või pahaloomulisi kahjustusi hinnata, saab kasutada EUS-juhitavat peennõela aspiratsiooni/biopsiat (endoskoopilise ultraheli juhendamisel tehtav peennõela aspiratsioon).Nõela aspiratsioon/biopsia, EUS-FNA/FNB), limaskesta sisselõike biopsia (mukosalintsisiooniga biopsia, MIAB) jne. teostavad biopsiaproovide võtmise preoperatiivseks patoloogiliseks hindamiseks. Arvestades EUS-FNA piiranguid ja sellele järgnevat mõju endoskoopilisele resektsioonile, saavad kogenud eksperdid endoskoopilise kirurgia jaoks sobivaid patsiente, kes tagavad kasvaja täieliku resektsiooni, ravida küpse endoskoopilise ravi tehnoloogiaga osakondades. Endoskoopik teostab endoskoopilist resektsiooni otse ilma preoperatiivset patoloogilist diagnoosi saamata.
Igasugune patoloogiliste proovide võtmise meetod enne operatsiooni on invasiivne ja kahjustab limaskesta või põhjustab adhesiooni submukosaalsele koele, suurendades seeläbi operatsiooni raskust ja võimalikku verejooksu riski.ja kasvaja levik. Seetõttu ei ole preoperatiivne biopsia tingimata vajalik. Vajalik, eriti seljaaju kasvajate puhul, mida saab diagnoosida tavapärase endoskoopia ja EUS-i kombinatsiooniga, näiteks lipoomid, tsüstid ja ektoopiline pankreas, koeproovi võtmist ei ole vaja.
2.SMT endoskoopiline ravint
(1)Ravipõhimõtted
Kahjustused, millel puuduvad lümfisõlmede metastaasid või mille lümfisõlmede metastaaside risk on väga madal, saab endoskoopiliste tehnikate abil täielikult eemaldada ning millel on madal jääk- ja kordumise risk ning mis sobivad endoskoopiliseks resektsiooniks, kui ravi on vajalik. Kasvaja täielik eemaldamine minimeerib jääkkasvaja ja kordumise riski.Endoskoopilise resektsiooni ajal tuleks järgida kasvajavaba ravi põhimõtet ja resektsiooni ajal tagada kasvajakapsli terviklikkus.
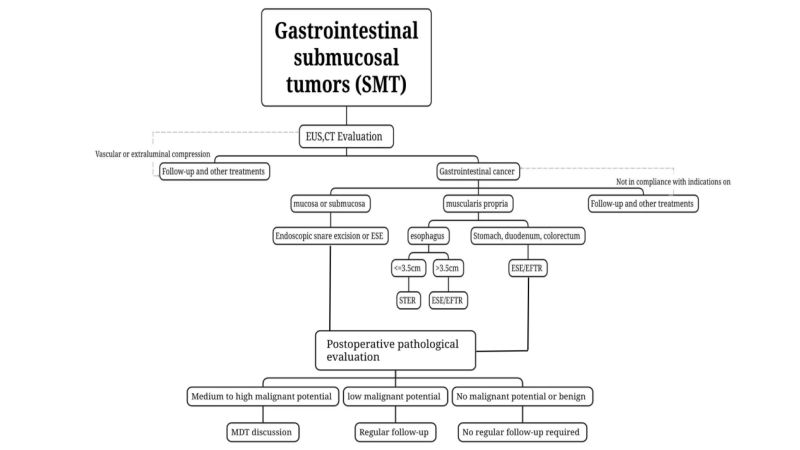
(2) Näidustused
i. Preoperatiivse uuringu käigus kahtlustatavad või biopsiaga kinnitatud pahaloomulised kasvajad, eriti need, mille puhul kahtlustatakse seedetrakti kasvajaid.ST, mille puhul preoperatiivsel hindamisel on kasvaja pikkus ≤2 cm ja madal kordumise ja metastaaside risk ning täieliku resektsiooni võimalus, saab endoskoopiliselt resekteerida; pika läbimõõduga kasvajate puhul, mille kahtluse korral on madala riskiga GIST >2 cm, kui lümfisõlmed või kauged metastaasid on preoperatiivsest hindamisest välistatud, võivad kogenud endoskoopiaarstid endoskoopilise operatsiooni teha osakonnas, kus on olemas väljaarenenud endoskoopiline ravitehnoloogia.
ii. Sümptomaatiline (nt verejooks, obstruktsioon) SMT.
iii. Patsiendid, kelle kasvajaid kahtlustatakse preoperatiivse uuringu põhjal healoomulisteks või patoloogia kinnitab seda, kuid keda ei saa regulaarselt jälgida või kelle kasvajad suurenevad lühikese aja jooksul jälgimisperioodil ja kellel on tugev soove endoskoopiliseks raviks.
(3) Vastunäidustused
i. Tuvastage kahjustused, mis mind vaevavadmaitse ulatuvad lümfisõlmedesse või kaugematesse kohtadesse.
ii. Mõnede selge lümfisõlmega SMT puhulnodeVõi kaugete metastaaside korral on patoloogia saamiseks vajalik ulatuslik biopsia, mida võib pidada suhteliseks vastunäidustuseks.
iii. Pärast üksikasjalikku preoperatiivsetHinnangu kohaselt on üldine seisund halb ja endoskoopiline operatsioon ei ole võimalik.
Healoomulised kahjustused, nagu lipoom ja ektoopiline pankreas, ei põhjusta üldiselt selliseid sümptomeid nagu valu, verejooks ja obstruktsioon. Kui SKui MT avaldub erosioonina, haavandina või suureneb lühikese aja jooksul kiiresti, suureneb pahaloomulise kahjustuse tekkimise võimalus.
(4) Resektsioonimeetodi valikd
Endoskoopiline tsüstilise haava resektsioon:Kui SMT on suhteliselt pealiskaudne, ulatub preoperatiivsete EUS- ja KT-uuringute põhjal õõnsusse ning seda saab korraga täielikult kangiga eemaldada, saab kasutada endoskoopilist kangresektsiooni.
Kodumaised ja välismaised uuringud on kinnitanud, et see on ohutu ja efektiivne pindmise SMT korral, mille verejooksu risk on 4–13% ja perforatsioon.risk 2–70%.
Endoskoopiline submukosaalne kaevamine, ESE: SMT-de puhul, mille läbimõõt on ≥2 cm või kui preoperatiivsed pildiuuringud, näiteks EUS ja KT, seda kinnitavad.Kui kasvaja ulatub õõnsusse, on ESE teostatav kriitiliste SMT-de endoskoopiliseks varruka resektsiooniks.
ESE järgib tehnilisi harjumusiEndoskoopiline submukosaalne dissektsioon (ESD) ja endoskoopiline limaskesta resektsioon ning rutiinselt kasutab kasvaja ümber ringikujulist "flip-top" sisselõiget, et eemaldada SMT-d kattev limaskest ja paljastada kasvaja täielikult, et saavutada kasvaja terviklikkuse säilitamise, operatsiooni radikaalsuse parandamise ja intraoperatiivsete tüsistuste vähendamise eesmärk. Kasvajate puhul, mille suurus on ≤1,5 cm, on võimalik saavutada 100% täielik resektsioonimäär.
Submukosaalne tunnel-endoskoopiline resektsioonioon, STER: STER võib olla eelistatud ravimeetod söögitoru, hilumi, mao väikese kõveruse, mao antrumi ja pärasoole muscularis propriast pärineva SMT korral, kus on lihtne tunneleid rajada ja mille põikiläbimõõt on ≤ 3,5 cm.
STER on uus tehnoloogia, mis on välja töötatud peroraalse endoskoopilise söögitoru sfinkterotoomia (POEM) põhjal ja on ESD-tehnoloogia laiendus.noloogia. STER-i en bloc resektsiooni määr SMT ravis ulatub 84,9% kuni 97,59% -ni.
Endoskoopiline täispaksusega resektsioonioon, EFTR: Seda saab kasutada SMT puhul, kui tunneli loomine on keeruline või kui kasvaja maksimaalne põikiläbimõõt on ≥3,5 cm ja see ei sobi STER-i jaoks. Kui kasvaja ulatub purpurse membraani alla või kasvab väljaspool õõnsuse osa ning operatsiooni käigus selgub, et kasvaja on serooskihi külge tihedalt kinnitunud ja seda ei saa eraldada, saab seda kasutada. EFTR teostab endoskoopilist ravi.
Perforatsiooni nõuetekohane õmblemineEFTR-i edu võti on õige koht pärast perforatsiooni. Kasvaja kordumise riski täpseks hindamiseks ja kasvaja leviku riski vähendamiseks ei ole soovitatav resekteeritud kasvajaproovi EFTR-i ajal lõigata ja eemaldada. Kui kasvaja on vaja tükkidena eemaldada, tuleb esmalt parandada perforatsioon, et vähendada kasvaja külvi ja leviku riski. Mõned õmblusmeetodid hõlmavad järgmist: metallklambriga õmblus, imemisklambriga õmblus, salmiklapi õmblustehnika, nailonköie ja metallklambriga kombineeritud "kotiõmbluse" meetod, metallklambriga sulgemissüsteem (üle optilise ümbrise, OTSC), OverStitch õmblus ja muud uued tehnoloogiad seedetrakti vigastuste parandamiseks ja verejooksu korral jne.
(5) Postoperatiivsed tüsistused
Intraoperatiivne verejooks: verejooks, mis põhjustab patsiendi hemoglobiini langust rohkem kui 20 g/l.
Massiivse intraoperatiivse verejooksu vältimiseksOperatsiooni ajal tuleks teha piisav submukosaalne süstimine, et paljastada suuremad veresooned ja hõlbustada elektrokoagulatsiooni verejooksu peatamiseks. Operatsiooniaegset verejooksu saab ravida erinevate sisselõikenugade, hemostaatiliste tangide või metallklambritega ning dissektsiooniprotsessi käigus leitud paljastunud veresoonte ennetava hemostaasi abil.
Postoperatiivne verejooks: Postoperatiivne verejooks avaldub vere oksendamise, melena või vere esinemisena väljaheites. Rasketel juhtudel võib tekkida hemorraagiline šokk. See tekib enamasti 1 nädala jooksul pärast operatsiooni, kuid võib tekkida ka 2–4 nädalat pärast operatsiooni.
Operatsioonijärgne verejooks on sageli seotudtegurid nagu halb postoperatiivne vererõhu reguleerimine ja maohappe poolt tekitatud jääkveresoonte söövitamine. Lisaks on postoperatiivne verejooks seotud ka haiguse asukohaga ning esineb sagedamini mao antrumis ja pärasoole alumises osas.
Hilinenud perforatsioon: Tavaliselt avaldub see kõhu paisumise, süveneva kõhuvalu, peritoniidi tunnuste, palaviku ja pildiuuringu tulemusel ilmneva gaaside kogunemise või suurenenud gaaside kogunemise näol võrreldes varasemaga.
See on enamasti seotud selliste teguritega nagu haavade halb õmblemine, liigne elektrokoagulatsioon, liiga vara ärkamine liikumiseks, liiga vara söömine, halb veresuhkru kontroll ja haavade erosioon maohappe poolt. a. Kui haav on suur või sügav või haaval on lõhesidb. Diabeediga patsiendid peaksid rangelt kontrollima oma veresuhkrut; väikeste perforatsioonide ja kergete rindkere- ja kõhuõõneinfektsioonidega patsientidele tuleks anda ravi, näiteks paastumine, infektsioonivastane ravi ja happe supressioon; c. Efusiooniga patsientidele võib teha suletud rindkere drenaaži ja kõhu punktsiooni. Sujuva drenaaži säilitamiseks tuleks paigaldada sondid; d. Kui infektsiooni ei õnnestu konservatiivse raviga lokaliseerida või see on kombineeritud raske rindkere-kõhuõõneinfektsiooniga, tuleks võimalikult kiiresti teha kirurgiline laparoskoopia ning parandada perforatsioon ja teha kõhuõõne drenaaž.
Gaasidega seotud tüsistused: sh nahaalune kudeneoosne emfüseem, pneumomediastinum, pneumotooraks ja pneumoperitoneum.
Intraoperatiivne nahaalune emfüseem (avaldub emfüseemina näol, kaelal, rinnal ja munandikotil) ja mediastiinumi pneumofüseem (sKõrvapealise turset võib avastada gastroskoopia ajal) ei vaja tavaliselt spetsiaalset ravi ja emfüseem taandub üldiselt iseenesest.
Raske pneumotooraks tekib doperatsiooni ajal [hingamisteede rõhk ületab operatsiooni ajal 20 mmHg]
(1 mmHg = 0,133 kPa), SpO2 < 90%, kinnitatud erakorralise voodiäärse rindkere röntgenpildiga], operatsiooni saab sageli jätkata pärast suletud rindkere drenaažiinaealine.
Patsientidel, kellel operatsiooni ajal ilmneb pneumoperitoneum, kasutage McFarlandi punkti läbistamiseks pneumoperitoneumi nõela.paremasse alakõhusse õhu väljalaskmiseks ja jätke punktsioonnõel paika kuni operatsiooni lõpuni ning seejärel eemaldage see pärast seda, kui olete veendunud, et gaasi ei eraldu.
Seedetrakti fistul: endoskoopilise kirurgia tagajärjel tekkinud seedevedelik voolab lekke kaudu rindkere või kõhuõõnde.
Söögitoru mediastiinumi fistulid ja ösofagotorakaalsed fistulid on levinud. Kui fistul tekib, tehke suletud rindkere drenaaž, et säilitadasujuva drenaaži tagamiseks ja piisava toitumisalase toetuse tagamiseks. Vajadusel saab kasutada metallklambreid ja mitmesuguseid sulgemisvahendeid või kogu katte taaskasutada. Blokeerimiseks kasutatakse stente ja muid meetodeid.fistul. Rasked juhud vajavad kiiret kirurgilist sekkumist.
3. Postoperatiivne ravi (fjärelkasvuga)
(1) Healoomulised kahjustused:Patoloogiasoovitab, et healoomulised kahjustused, nagu lipoom ja leiomüoom, ei vaja kohustuslikku regulaarset järelkontrolli.
(2) SMT ilma pahaloomulisesipelgate potentsiaal:Näiteks 2 cm läbimõõduga rektaalsete NET-ide ja keskmise ning kõrge riskiga GIST-i korral tuleks teha täielik staadiumi määramine ning tõsiselt kaaluda lisaravi (kirurgia, keemiaravi, sihipärane ravi). Plaani koostamine peaks põhinema multidistsiplinaarsel konsultatsioonil ja individuaalsel tasandil.
(3) Madala pahaloomulisuse potentsiaaliga SMT:Näiteks tuleb madala riskiga GIST-i hinnata EUS-i või pildiuuringu abil iga 6–12 kuu järel pärast ravi ja seejärel ravida vastavalt kliinilistele juhistele.
(4) Keskmise ja kõrge pahaloomulisuse potentsiaaliga SMT:Kui postoperatiivne patoloogia kinnitab 3. tüüpi mao NET-i, kolorektaalse NET-i pikkusega >2 cm ja keskmise ja kõrge riskiga GIST-i, tuleb teha täielik staadiumi määramine ja tõsiselt kaaluda täiendavaid ravimeetodeid (kirurgia, keemiaravi, sihipärane ravi). Plaani koostamine peaks põhinema[meist 0118.docx]multidistsiplinaarne konsultatsioon ja individuaalne lähenemine.
Meie, Jiangxi Zhuoruihua Medical Instrument Co., Ltd., on Hiina tootja, mis on spetsialiseerunud endoskoopilistele tarbekaupadele, näiteksbiopsia tangid, hemoclip, polüübilõks, skleroteraapia nõel, pihustuskateeter, tsütoloogiaharjad, juhttraat, kivide kogumise korv, nina sapiteede drenaažikateeterjne, mida kasutatakse laialdaseltElektrooniline mälu, ESD,ERCPMeie tooted on CE-sertifikaadiga ja meie tehased ISO-sertifikaadiga. Meie kaupu on eksporditud Euroopasse, Põhja-Ameerikasse, Lähis-Itta ja osaliselt Aasiasse ning oleme pälvinud klientidelt laialdast tunnustust ja kiitust!
Postituse aeg: 18. jaanuar 2024


